2020. 5. 16. 10:39ㆍMetallurgical Processing/Electrowinning (전해채취)
전해채취(electrowinning)는 습식제련 공정의 마지막 단계라 할 수 있으며, 조금속(crude metal)을 양극으로 사용하는 전해정련(electrorefining)과는 다르게 불용성 양극을 사용합니다.
[참고] 전해채취 - 전해정련의 차이
전해채취를 통해 주로 생산되는 금속은 구리, 아연, 니켈, 코발트 등이 있으며, 전해채취의 원리 및 석출량 계산에 대한 예시는 구리 전해채취를 통하여 설명 드리겠습니다.
· 양극반응: H2O → 2H+ + ½O2 + 2e-
· 음극반응: Cu2+ + 2e- → Cu
각 극에서의 반응을 통해 알 수 있듯, 양극은 불용성(비소모성) 전극이며 산소를 발생 시킵니다. 이 과정에서 발생한 전자(e)는 음극으로 이동하고 구리이온을 환원 시키는데 사용됩니다. 이와 같은 전해채취의 목적을 달성하기 위해서는 가장 기본적인 시설 및 장비인 전해조(electrolytic cell)와 양극 및 음극(anode & cathode)이 필수입니다.
전해채취 장비의 기본구성
(1) Electrolytic cell: 전해조
전착은 전해조(electrolytic cell)에서 이루어집니다. 전해조의 구성은 아래와 같습니다.

· Cathode(①): 전자를 받아 금속의 전착이 이루어지는 곳
· Anode(②): 비소모성(불용성)이며, 물의 전기분해를 통하여 산소와 수소이온 및 전자를 발생시킴
· Distribution Manifold(③): 전해조 전체에 전해액이 골고루 퍼지도록 도와주는 장치
· Busbar(④): 전해조에 전기를 공급해주도록 하는 장치
(2) Anode & cathode: 음극과 양극
양극과 음극은 서로 번갈아 끼워지며, 음극의 양면에 금속이 전착되도록 양극의 개수는 음극에 비하여 한 개 더 설치가 됩니다. 음극과 양극의 간략한 구성은 아래와 같습니다.

· Edge strip(⑤): 절연체(insulator)로, 음극의 모퉁이에 설치되어 양 면에 전착되는 금속이 서로 붙는 것을 방지하여 음극에서 금속의 회수가 용이하도록 도와주는 장치
· Hanger bar(⑥): 전해조의 busbar와 맞닿아 전기를 통하게 해주는 곳
· Cathode active area(⑦): Edge strip이 끼워진 부분을 제외한, 실질적으로 금속이 전착되는 면적
· Hook(⑧): 전해조에서 음극을 크레인에 걸어 건져내기 위한 장치
전착과 전착량의 계산(이론적 금속 석출량)
전해채취를 통해, 금속은 음극에서 석출되며 이를 전착(Electro deposition)이라고 합니다. 이 때, 특정시간(sec)동안 전류(A)를 흘려줄 때의 구리 전착량(g)은 아래와 같이 계산될 수 있습니다(이론적 계산량). 실제 금속의 전착량을 계산하는 식의 바탕이 되며, 현장에서 사용되는 식에는 몇 가지 변수가 추가될 수 있습니다.
[참고] Cellhouse 디자인: 생산량, 전류효율, 전류밀도 및 전해조 개수

MW: 구리의 몰질량(63.546g/mol)
n: 전해액에 녹아있는 구리이온의 이온가(2)
Faraday: 패러데이 상수. 1몰의 전자가 가지는 전하량(96485Amp·sec/mol)
A: 전해조에 공급되는 전류(Amp)
Time: 전류를 공급해준 시간(sec)
식 (1)을 이용하여, 전류 A만큼 지속적으로 공급해줄 때 시간 당 전착되는 구리의 양(ton/hr)은 아래의 식 (2)와 같이 구할 수 있습니다.
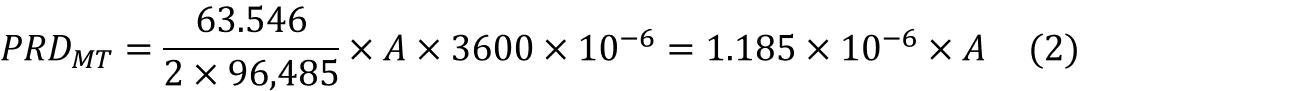
'Metallurgical Processing > Electrowinning (전해채취)' 카테고리의 다른 글
| 전해채취 - 평활제(Leveler/Smoothing additives) (0) | 2022.01.02 |
|---|---|
| 전해채취 - 아노드 백(Anode Bag) (0) | 2021.12.07 |
| 전해채취 - Shorting Frame (0) | 2021.06.26 |
| 전해채취 - Acid mist의 발생과 억제방법 (0) | 2020.06.04 |
| 전해채취 - Cellhouse 디자인: 생산량, 전류효율, 전류밀도 및 전해조 개수 (2) | 2020.05.31 |
