2022. 6. 1. 14:33ㆍMetallurgical Processing/기본이론
물 혹은 산/알칼리 용액에는 수소 이온(H+)과 수산화 이온(OH-)이 공존합니다. 이 때, 용액에 H+농도와 OH-농도가 동일할 시 중성, H+가 많으면 산성, OH-가 많으면 알칼리성이 됩니다. 순수(pure water)라 하더라도, 25℃에서 아래 식 (1)과 같이 아주 작은 양이 전리(electrolytic dessociation)됩니다.

용액 내 두 이온의 농도는 [H+]=[OH-]=10-7이며 두 이온의 농도가 같기 때문에 중성입니다. 또한, [H+]X[OH-]=10-14의 관계식이 성립하기에, 한 이온의 농도 값이 정해지면 나머지 하나의 값은 자동적으로 정해지기 때문에, 일반적으로 액성의 판정은 [H+]의 값만 알면 됩니다.
pH(피에이치 혹은 페하)는 수소 이온 농도에 대한 지수(potential of Hydrogen)입니다. 위의 농도를 아래의 로그 스케일로 나타내어 표시한 것입니다. 수소 이온과 수산화 이온의 관계식을 이용하여 pOH로 나타낼 수도 있습니다.


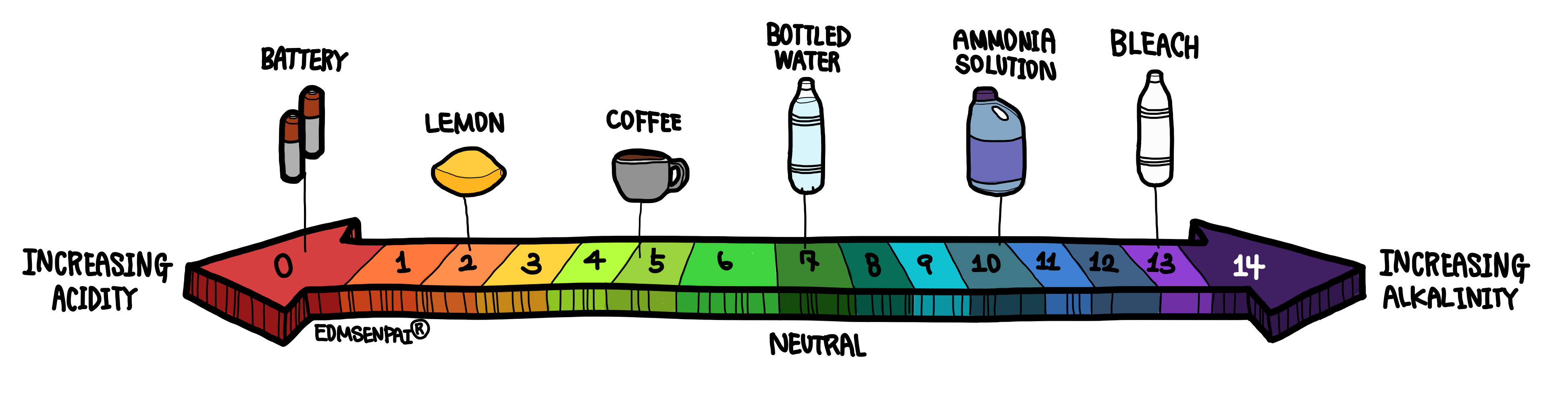
농도가 같은 경우 pH는 7이 되기 때문에, pH 7을 중성, 그보다 낮으면 산성, 높으면 알칼리성이 됩니다.
위에 언급 되었듯 pH는 로그 스케일입니다. 따라서, 구간에 따라 용액 내에 수소 이온 또는 수산화 이온 양의 차이가 많이 나게 됩니다. 똑같이 pH가 1이 차이난다고 하여도, 각각의 경우(강산성부터 강알칼리성까지)에 따라 수소 혹은 수산화 이온의 절대량 차이는 같지 않습니다. 따라서, 용액의 pH를 조절하는 경우, 이를 충분히 고려하여야 합니다.
'Metallurgical Processing > 기본이론' 카테고리의 다른 글
| 입자의 반응 속도모델 (0) | 2022.06.20 |
|---|---|
| Arrhenius's equation(아레니우스 식) (0) | 2022.06.20 |
| Roasting(배소) (0) | 2022.02.05 |
| Calcination(가소, 하소) (0) | 2022.02.04 |
| Faraday Constant(패러데이 상수) (0) | 2022.02.03 |
